中國(guó)消費(fèi)者報(bào)北京訊(記者孟剛)為進(jìn)一步保障公眾用藥安全,,國(guó)家藥品監(jiān)督管理局近日決定對(duì)對(duì)乙酰氨基酚常釋及緩釋制劑說(shuō)明書(shū)【不良反應(yīng)】【注意事項(xiàng)】等項(xiàng)進(jìn)行修訂。其中,,常釋及緩釋制劑增加了“過(guò)量使用乙酰氨基酚可引起嚴(yán)重肝損傷”等警示用語(yǔ),。而常釋劑處方藥和非處方藥【不良反應(yīng)】均增加了:極少數(shù)患者使用對(duì)乙酰氨基酚可能出現(xiàn)致命的,、嚴(yán)重的皮膚不良反應(yīng)。
此外,,此次修訂涉及泰諾林等兒童發(fā)熱常用藥,,根據(jù)此次修訂,對(duì)乙酰氨基酚緩釋干混懸劑用法用量由目前的“24小時(shí)不超4次”修改為“24小時(shí)不超過(guò)3次,。”
根據(jù)公告,,緩釋制劑中的對(duì)乙酰氨基酚緩釋片和對(duì)乙酰氨基酚緩釋干混懸劑用法用量均進(jìn)行了修改:“成人和12歲以上兒童一次1片(包),若持續(xù)發(fā)熱或疼痛,,每8小時(shí)一次,,24小時(shí)不超過(guò)3次。”對(duì)乙酰氨基酚緩釋片和對(duì)乙酰氨基酚緩釋干混懸劑【不良反應(yīng)】項(xiàng)下均增加“過(guò)量服用對(duì)乙酰氨基酚可引起嚴(yán)重肝損傷,。”,,【注意事項(xiàng)】項(xiàng)下均增加“嚴(yán)格按說(shuō)明書(shū)使用。成人或兒童過(guò)量服用無(wú)論是否出現(xiàn)不適癥狀,,均應(yīng)立即就診,。”以及“N-乙酰半胱氨酸是對(duì)乙酰氨基酚中毒的拮抗藥,宜盡早應(yīng)用,,12小時(shí)內(nèi)給藥療效滿意,,超過(guò)24小時(shí)療效較差。”
對(duì)乙酰氨基酚為止痛藥,,適用于普通感冒或流行性感冒引起的發(fā)熱,,也用于緩解輕至中度疼痛如頭痛、關(guān)節(jié)痛,、偏頭痛,、牙痛、肌肉痛,、神經(jīng)痛等,。
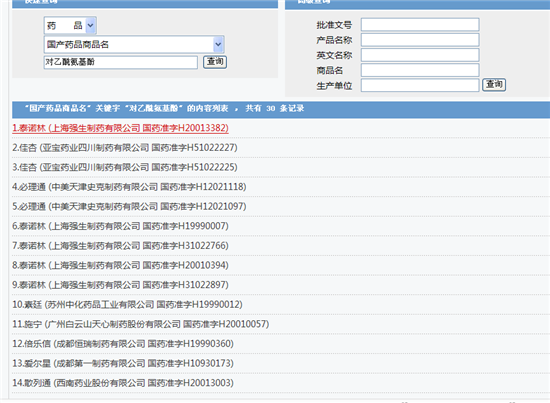
記者3月6日在國(guó)家藥品監(jiān)督管理局以“對(duì)乙酰氨基酚”查詢發(fā)現(xiàn),共有3004條批文,涉及上海強(qiáng)生,、上海黃海制藥等企業(yè),,而查詢藥品商品名發(fā)現(xiàn),共涉及泰諾林,、必理通,、安怡等30條記錄。如兒童發(fā)熱常用藥“泰諾林”共有7條批文,,涉及片劑,、混懸滴劑、口服溶液劑,、混懸劑等,,不過(guò)沒(méi)有發(fā)現(xiàn)“干混懸劑”。不過(guò)上海強(qiáng)生制藥有限公司的一位客服3月6日在電話中也向記者確認(rèn),,此次修訂涉及到泰諾林,。
常釋制劑處方藥【不良反應(yīng)】項(xiàng)增加:有報(bào)道,極少數(shù)患者使用對(duì)乙酰氨基酚可能出現(xiàn)致命的,、嚴(yán)重的皮膚不良反應(yīng)等內(nèi)容,。【注意事項(xiàng)】增加,,超劑量使用對(duì)乙酰氨基酚可引起嚴(yán)重肝損傷,、過(guò)敏體質(zhì)者慎用等4項(xiàng)內(nèi)容。
常釋制劑非處方藥【不良反應(yīng)】項(xiàng)增加:有報(bào)道,,極少數(shù)患者使用對(duì)乙酰氨基酚可能出現(xiàn)致命的,、嚴(yán)重的皮膚不良反應(yīng)、過(guò)量使用對(duì)乙酰氨基酚可引起嚴(yán)重肝損傷等2項(xiàng)內(nèi)容,?!咀⒁馐马?xiàng)】增加:過(guò)敏體質(zhì)者慎用,對(duì)本品過(guò)敏者禁用;因過(guò)量使用對(duì)乙酰氨基酚有引起嚴(yán)重肝損傷的報(bào)道,,應(yīng)嚴(yán)格按說(shuō)明書(shū)使用等4項(xiàng)內(nèi)容,。
另外,氨酚氯雷偽麻緩釋片和氯雷氨酚偽麻緩釋片均在【適應(yīng)癥】項(xiàng)下刪除“季節(jié)性過(guò)敏性鼻炎”,。
此外,,緩釋制劑統(tǒng)一增加警示語(yǔ):“過(guò)量使用對(duì)乙酰氨基酚緩釋制劑可引起嚴(yán)重肝損傷,長(zhǎng)期飲酒,、肝功能異常者使用對(duì)乙酰氨基酚發(fā)生肝損傷的風(fēng)險(xiǎn)更高,。”
國(guó)家藥監(jiān)局要求,所有對(duì)乙酰氨基酚常釋及緩釋制劑生產(chǎn)企業(yè)均應(yīng)依據(jù)《藥品注冊(cè)管理辦法》等有關(guān)規(guī)定,,按照對(duì)乙酰氨基酚常釋及緩釋制劑說(shuō)明書(shū)修訂要求,,提出修訂說(shuō)明書(shū)的補(bǔ)充申請(qǐng),,于2020年5月20日前報(bào)省級(jí)藥品監(jiān)管部門(mén)備案。修訂內(nèi)容涉及藥品標(biāo)簽的,,應(yīng)當(dāng)一并進(jìn)行修訂;說(shuō)明書(shū)及標(biāo)簽其他內(nèi)容應(yīng)當(dāng)與原批準(zhǔn)內(nèi)容一致,。在補(bǔ)充申請(qǐng)備案后9個(gè)月內(nèi)對(duì)所有已出廠的藥品說(shuō)明書(shū)及標(biāo)簽予以更換。

官方微信公眾號(hào)

官方微博