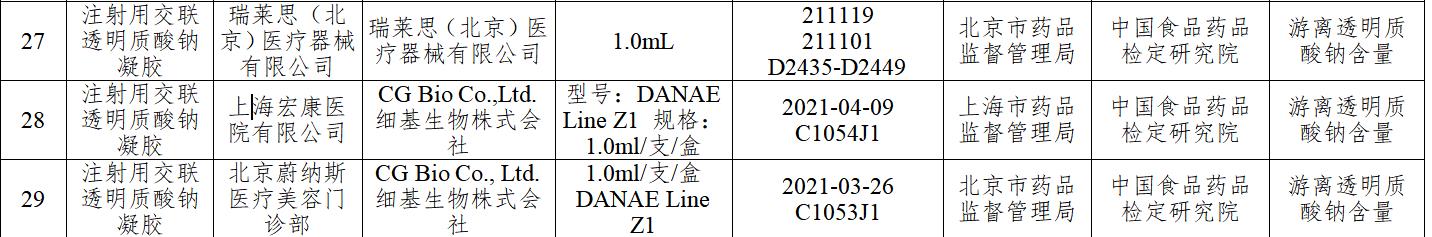
中國消費者報北京訊(記者孟剛)國家藥監(jiān)局1月4日發(fā)布國家醫(yī)療器械監(jiān)督抽檢結果的通告(第4號)(2022年第63號),,對涉及10個品種進行了產品質量監(jiān)督抽檢,發(fā)現29批(臺)產品不符合標準規(guī)定,,其中有3批次注射用透明質酸鈉凝膠不合格,,涉及CG Bio Co.,Ltd.細基生物株式會社生產的婕爾DANAE Line和瑞萊思(北京)醫(yī)療器械有限公司(以下簡稱瑞萊思)。
透明質酸鈉即為俗稱的玻尿酸,。記者梳理發(fā)現,此次3批次不合格注射用透明質酸鈉凝膠中,,有1批次由瑞萊思(北京)醫(yī)療器械有限公司生產,,兩批次C1054J1、C1053J1由CG Bio Co.,Ltd.細基生物株式會社生產的DANAE Line,,不合格項目均為游離透明質酸鈉含量,。
記者了解到,CG Bio Co.,Ltd.細基生物株式會社為韓國大熊制藥株式會社(DAEWOONG)旗下公司,,其旗下玻尿酸品牌為婕爾GISELLELIGNE,,共計有3種型號,分別為:DANAE Original,、DANAE Line、DANAE Contour,,其中,,不含利多卡因的DANAE Line于2019年3月獲批上市。
經國家藥監(jiān)局網站查詢得知,DANAE Line為進口產品,,注冊編證號為國械注進20193130095,,國內代理人為北京大熊偉業(yè)醫(yī)藥科技有限公司。DANAE Line產品有兩種規(guī)格,,1ml/支裝量的由預灌裝凝膠的注射器及兩支27G1/2的注射針組成,;3ml/支裝量的由預灌裝凝膠及注射器組成。產品適用于面部真皮組織中層至深層注射以糾正中重度鼻唇溝皺紋,。該透明質酸鈉凝膠含透明質酸鈉、磷酸鹽緩沖液和注射用水,。透明質酸鈉濃度為20mg/ml,其中經BDDE(一種交聯劑)交聯的透明質酸鈉含量17.65mg/ml,,非交聯透明質酸鈉2.35mg/ml,貨架有效期3年,。
3批次注射用玻尿酸不符合規(guī)定,。
記者了解到,,2022年7月,北京大熊偉業(yè)醫(yī)藥科技有限公司報告,,CG Bio Co., Ltd.細基生物株式會社對和此次抽檢公布顯示相同的C1053J1、C1054J1批次DANAE LineZ1注射用交聯透明質酸鈉凝膠進行召回,。召回原因為經2022年國家醫(yī)療器械抽查檢驗,游離透明質酸鈉含量不符合《產品技術要求》中的性能指標要求,?!懂a品技術要求》中規(guī)定游離透明質酸鈉的范圍值為標識含量的90%-120%,而2022年召回的兩批次C1053J1,、C1054J1產品分別為151%,,149%,。
此次抽檢不合格與去年召回時所稱的抽檢情況是否是同一事件?《中國消費者報》記者聯系到北京大熊偉業(yè)醫(yī)藥科技有關工作人員,,對方表示了解情況后將進行反饋,。截至發(fā)稿,記者未收到回復,。
此外,,瑞萊思生產的批號為211101的注射用透明質酸鈉凝膠也因游離透明質酸鈉含量項目不合格。
對上述不符合標準規(guī)定產品,,國家藥品監(jiān)督管理局已要求醫(yī)療器械注冊人所在地省級藥品監(jiān)督管理部門按照《醫(yī)療器械監(jiān)督管理條例》《醫(yī)療器械生產監(jiān)督管理辦法》《醫(yī)療器械召回管理辦法》等要求,,及時作出行政處理決定并向社會公布。
記者1月5日在信用中國網站查詢發(fā)現,,北京市場監(jiān)管局2022年12月開具的行政處罰書顯示,,瑞萊思2021年11月16日開始生產注射用交聯透明質酸鈉凝膠(批號:211101),2022年1月11日完成生產,,共計生產2489支,,質量留樣80支。2022年3月21日,,北京市藥品監(jiān)督管理局抽檢15支產品,,經中國食品藥品檢定研究院檢驗(檢驗報告編號:QC202204102),,游離透明質酸鈉含量項目檢驗結果為3.5mg/mL,,經注冊的產品技術要求規(guī)定為2.3±0.3,不符合經注冊的產品技術要求的規(guī)定,。2022年6月23日,,當事人申請復檢。2022年9月30日,,市場監(jiān)管部門收到北京市醫(yī)療器械檢驗研究院檢驗報告(報告編號:F-G-0004-2022),,游離透明質酸鈉含量項目檢驗結果為3.1mg/mL,不符合經注冊的產品技術要求,。2022年6月21日當事人自檢使用10支(來自質量留樣),,目前庫存2464支。處罰決定書顯示,,該產品沒有銷售,。按照當事人提供的相同產品其他批號銷售單價30.00元/支計算,該批產品貨值金額為74670元,。市場監(jiān)管部門責令當事人改正上述違法行為,,并處罰款746700元。